modelos atomicos
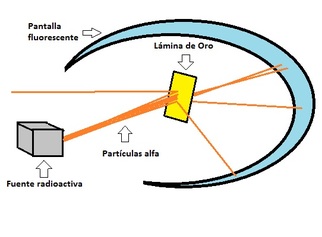
En 1910, Ernest Rutherford, un físico neozelandés, quiso poner a prueba el modelo atómico postulado por Sir Joseph Thomson, el cual consistió en que hacer pasar un rayo de partículas alfa (partículas cargadas positivamente) a través de una lámina de oro extremadamente delgada.
Este experimento se muestra de una manera muy sencilla en la Imagen y el video Los resultados obtenidos, llevaron a Rutherford a plantear su propio modelo atómico,.
Las principales conclusiones que se obtuvieron fueron:
Ahora, bien, ¿por qué no era válido el modelo del thomson ?
- El átomo es mayormente vacío, lo que explicaría el porque la mayoría de las partículas atravesaron la lámina de oro sin sufrir desviación.
- El átomo posee un centro denso, que abarca la totalidad de la masa. Además, este centro, llamado núcleo, está cargado positivamente, razón por la cual, las partículas alfa al acercarse a él sufrían desviaciones (cargas iguales se repelen).
- Debido a que el átomo es eléctricamente neutro, los electrones deben estar rodeando al núcleo, girando alrededor de él, tal y como lo hacen los planetas alrededor del Sol. La cantidad de electrones es igual y de signo contrario a la carga ubicada en el núcleo.
Ahora, bien, ¿por qué no era válido el modelo del thomson ?
el modelo que regía hasta ese entonces consideraba al átomo como una esfera compacta, dentro de la cual tenía incrustados a los electrones.
Si ese modelo hubiese sido correcto, las partículas alfa tendrían que haber rebotado en la lámina de oro, ya que ocurriría el mismo efecto de cuando uno hacer chocar dos bolitas, pero el hecho de que la mayoría atravesara la lámina de oro, indica que esa concepción atómica no era cierta
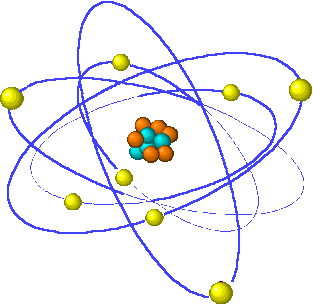
Imágen 5: Modelo atómico Planetario de Rutherford (obtenida desde http://rabfis15.uco.es/)
En 1886, Eugen Goldstein descubrió protones.
Al inicio de la década de 1930, James Chadwick, quien fuese alumno de Rutherford, descubrió la presencia de una partícula sin carga, de masa aproximadamente igual a la del protón, la cúal fue llamada neutrón,
Comentarios
Publicar un comentario